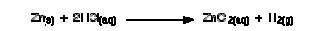Tujuan Kegiatan Belajar
Siswa diharapkan mampu memahami pengaruh konsentrasi, suhu, dan luas permukaan bidang sentuh pada laju reaksi.Untuk lebih memahami materi ini disarankan untuk memahami juga tentang Teori Tumbukan.
FAKTOR – FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Pengalaman menunjukkan bahwa serpihan kayu terbakar lebih cepat daripada balok kayu. Hal ini berarti bahwa reaksi yang sama dapat berlangsung dengan kelajuan yang berbeda, bergantung pada keadaan zat pereaksi. Dalam materi ini akan dibahas faktor – faktor yang mempengaruhi laj reaksi. Dalam kehidupan sehari sering kita jumpai tentang peristiwa yang menerapkan prinsip faktor-faktor yang mempengaruhi laju reaksi antara lain:
- Makanan yang disimpan dalam kulkas dapat bertahan lebih lama
- Bahan makanan yang dipotong-potong matang lebih cepat
- Mencuci dengan detergen yang lebih banyak membuat pakaian lebih bersih
- Pembakaran zat makanan dalam tubuh dapat berlangsung pada suhu tubuh yang relative rendah, sedangkan di laboratorium pembakaran serupa hanya dapat berlangsung pada suhu yang jauh lebih tinggi.
- Pengetahuan tentang hal ini memungkinkan kita dapat mengendalikan laju reaksi, yaitu melambatkan reaksi yang merugikan dan menambah laju reaksi yang menguntungkan.
Adapun faktor - faktor yang memengaruhi laju suatu reaksi antara lain:
1. Konsentrasi
Semakin besar konsentrasi, semakin besar pula kemungkinan partikel saling bertumbukan, sehingga reaksi bertambah cepat.Banyaknya zat terlarut di dalam sejumlah pelarut disebut konsentrasi. Semakin banyak pereaksi (zat terlarut), maka akan semakin besar pula konsentrasi larutan. Suatu larutan dengan konsentrasi tinggi mengandung partikel yang lebih banyak, jika dibandingkan dengan larutan dengan konsentrasi yang lebih rendah. Pada konsentrasi tinggi, memungkinkan tumbukan yang terjadi akan lebih banyak, sehingga membuka peluang semakin banyak tumbukan efektif yang menyebabkan laju reaksi menjadi lebih cepat. Akibatnya, hasil reaksi akan lebih cepat terbentuk. Beberapa contoh
1. Seng dan asam hidroklorida
Di labotarium, butiran seng beraksi cukup lambat dengan larutan asam hidroklorida, tetapi akan lebih cepat apabila konsentrasi dari asam ditingkatkan.
2. Dekomposisi katalis pada hidrogen peroxide
Mangan(IV) oksida padat biasa digunakan sebagai katalis dalam reaksi ini. Oksigen dihasilkan jauh lebih cepat apabila hidrogen peroxide dalam konsentrasi pekat daripada dalam konsentrasi encer.
3. Reaksi antara larutan natrium thiosulfat dan asam hidroklorida
Reaksi ini sering digunakan untuk menyelidiki relasi antara konsentrasi dan laju reaksi. Ketika larutan asam ditambahkan ke dalam larutan natrium thiosulfat, endapan berwarna kuning pucat dari belerang dihasilkan.
Semakin banyak larutan natrium thiosulfate menjadi encer, semakin lama juga endapan terbentuk.
2. Luas Permukaan Sentuhan
Semakin kecil ukuran suatu zat padat maka luas permukaan bidang sentuh zat padat tersebut semakin besar sehingga semakin cepat reaksi berlangsung. Bubuk zat padat biasanya menghasilkan reaksi yang lebih cepat dibandingkan sebuah bongkahan zat padat dengan massa yang sama, karena bubuk padat memiliki luas permukaan bidang sentuh yang lebih besar daripada sebuah bongkahan zat padat. Suatu zat akan bereaksi hanya jika zat tersebut bercampur atau bersentuhan dan terjadi tumbukan. Tumbukan tersebut terjadi antar luas permukaan bidang sentuh dari masing-masing molekul.
Suatu reaksi mungkin banyak melibatkan pereaksi dalam bentuk padatan. Bila kita mempunyai kubus dengan ukuran panjang, lebar dan tinggi masing-masing 1cm. Luas permukaan kubus bagian depan 1 cm x 1 cm = 1 cm2. Luas permukaan bagian belakang, kiri, kanan, atas dan bawah, masing-masing juga 1cm2. Jadi luas permukaan seluruhnya 6 cm2.
Kemudian kubus tersebut kita pecah jadi dua, maka luas permukaan salah satukubus hasil pecahan tadi adalah 2(1 cm x 1 cm) + 4 (0,5 cm x 1 cm) = 4 cm2. Berarti luas dua kubus hasil pecahan adalah 8 cm2. Apa yang dapat kita simpulkan mengenai hal ini? Jadi makin kecil pecahan tersebut, luas permukaannya makin besar dan permukaan sentuh tadi bereaksi dengan cairan atau gas.
Hal ini merupakan contoh bagaimana penurunan ukuran partikel dapat memperluas permukaan sentuh zat. suatu reaksi antara logam magnesium dengan larutan asam seperti asam hidroklorida. Reaksi melibatkan tumbukan antara atom magnesium dengan ion hidrogen.
Apa hubungannya dengan tumbukan? makin luas permukaan atom magnesium makin luas bidang sentuh atom magnesium dengan asam klorida, sehingga jumlah tumbukannya juga makin besar. Artinya makin kecil ukuran, makin luas permukaannya, makin banyak tumbukan, makin cepat terjadinya reaksi
Pengaruh luas permukaan banyak diterapkan dalam industri, yaitu dengan menghaluskan terlebih dahulu bahan yang berupa padatan sebelum direaksikan. Ketika kita makan, sangat dianjurkan untuk mengunyah makanan hingga lembut, agar proses reaksi di dalam lambung berlangsung lebih cepat dan penyerapan sari makanan lebih sempurna.
3. Suhu
Umumnya kenaikan suhu mempercepat reaksi, dan sebaliknya penurunan suhu memperlambat reaksi. Bila kita memasak nasi dengan api besar akan lebih cepat dibandingkan api kecil. Bila kita ingin mengawetkan makanan (misalnya ikan) pasti kita pilih lemari es, mengapa? Karena penurunan suhu memperlambat proses pembusukan.
Laju reaksi kimia bertambah dengan naiknya suhu. Bagaimana hal ini dapat terjadi? Ingat, laju reaksi ditentukan oleh jumlah tumbukan. Jika suhu dinaikkan, maka kalor yang diberikan akan menambah energi kinetik partikel pereaksi. Sehingga pergerakan partikel-partikel pereaksi makin cepat, makin cepat pergerakan partikel akan menyebabkan terjadinya tumbukan antar zat pereaksi makin banyak, sehingga reaksi makin cepat.
Umumnya kenaikan suhu sebesar 100oC menyebabkan kenaikan laju reaksi sebesar dua sampai tiga kali. Kenaikan laju reaksi ini dapat dijelaskan dari gerak molekulnya. Molekul-molekul dalam suatu zat kimia selalu bergerak-gerak. Oleh karena itu,kemungkinan terjadi tabrakan antar molekul yang ada. Tetapi tabrakan itu belum berdampak apa-apa bila energi yang dimiliki oleh molekul-molekul itu tidak cukup untuk menghasilkan tabrakan yang efektif. Kita telah tahu bahwa, energi yang diperlukan untuk menghasilkan tabrakan yang efektif atau untuk menghasilkan suatu reaksi disebut energi pengaktifan
Energi kinetik molekul-molekul tidak sama. Ada yang besar dan ada yang kecil. Oleh karena itu, pada suhu tertentu ada molekul-molekul yang bertabrakan secara efektif dan ada yang bertabrakan secara tidak efektif. Dengan perkataan lain, ada tabrakan yang menghasilkan reaksi kimia ada yang tidak menghasilkan reaksi kimia.
Energi minimum yang diperlukan disebut dengan reaksi aktivasi energi. Kita dapat menggambarkan keadaan dari energi aktivasi pada distribusi Maxwell-Boltzmann seperti ini:
Hanya partikel-partikel yang berada pada area di sebelah kanan dari aktivasi energi yang akan bereaksi ketika mereka bertumbukan. Sebagian besar dari partikel tidak memiliki energi yang cukup dan tidak menghasilkan reaksi. Untuk mempercepat reaksi, kita perlu untuk meningkatkan jumlah dari partikel-partikel energik - partikel-partikel yang memiliki energi sama atau lebih besar dari aktivasi energy. Peningkatan suhu merupakan pengaruh yang tepat.
Meningkatkan suhu reaksi berarti menambahkan energi. Energi diserap oleh molekul-molekul sehingga energi kinetik molekul menjadi lebih besar. Akibatnya, molekul-molekul bergerak lebih cepat dan tabrakan dengan dampak benturan yang lebih besar makin sering terjadi. Dengan demikian, benturan antar molekul yang mempunyai energi kinetik yang cukup tinggi itu menyebabkan reaksi kimia juga makin banyak terjadi. Hal ini berarti bahwa laju reaksi makin tinggi.
4. Tekanan
Banyak reaksi yang melibatkan pereaksi dalam wujud gas. Kelajuan dari reaksi seperti itu juga dipengaruhi tekanan. Penambahan tekanan dengan memperkecil volum akan memperbesar konsentrasi, dengan demkian memperbesar laju reaksi. Peningkatan tekanan dari gas adalah sama dengan peningkatan pada konsentrasi. Jika kita memilki gas dalam massa tertentu, semakin Anda meningkatkan tekanan semakin kecil juga volumenya. Jika kita memiliki massa yang sama dengan volume yang lebih kecil, maka semakin tinggi konsentrasinya.
5. Katalis
Diketahui bahwa laju reaksi dapat meningkat dengan tajam dengan naiknya suhu, tingginya konsentrasi pereaksi, dan luasnya bidang sentuh. Namun, terkadang cara- cara tersebut sulit untuk diterapkan karena adanya keterbatasan-keterbatasan yang ada, sebagai contoh sel makhluk hidup dapat bertahan pada rentang suhu yang agak rendah, dan tubuh manusia dirancang untuk beroperasi pada suhu relatif tetap sekitar 37°C. Namun, banyak reaksi biokimia yang begitu rumit dalam tubuh terlalu lambat pada suhu ini bila tanpa ada campur tangan zat lain. Sel tubuh bekerja hanya disebabkan tubuh mengandung banyak zat yang dinamakan enzim yang mampu meningkatkan laju reaksi biokimia dalam tubuh.
Enzim merupakan contoh katalis. Katalis adalah suatu zat yang dapat mempengaruhi laju/kecepatan suatu reaksi dan diperoleh kembali di akhir reaksi. Walaupun katalis bukan pereaksi, tetapi dalam pelaksanaannya turut andil dalam salah satu tahap mekanisme reaksi. Katalis memasuki satu tahap dan keluar pada tahap selanjutnya. Katalis dapat mempercepat laju reaksi dengan cara mencari jalan lain (mekanisme lain) yang memiliki energi aktivasi (energi pengaktifan) lebih rendah, sehingga katalis dapat mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi. Walaupun katalis menurunkan energi aktivasi reaksi tetapi tidak mempengaruhi perbedaan energi antara produk dan pereaksi, dengan kata lain katalis tidak mengubah entalpi reaksi. Katalis berperan hanya pada reaksi tertentu.
a. Jenis-Jenis Katalis
1) Katalis Homogen
Katalis homogen adalah katalis yang dapat bercampur secara homogen dengan pereaksinya. Contoh:
a) Katalis wujud gas dan pereaksi wujud gas
Katalis uap nitroso pembuatan gas SO3 dan gas SO2 dengan O2
b) Katalis wujud cair dan pereaksi wujud cair
Katalis asam pada proses hidrolisa sukrosa
2) Katalis Heterogen
Katalis heterogen adalah katalis yang tidak dapat bercampur secara homogen dengan pereaksinya. Contoh:
a) Katalis wujud padat dan pereaksi wujud gas
b) Katalis wujud padat dan pereaksi wujud padat
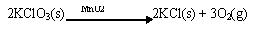
Katalis MnO2 pada penguraian KClO3
Di beberapa negara maju, kendaraan bermotor telah dilengkapi dengan katalisdari oksida logam atau paduan logam pada knalpotnya sehingga dapat mempercepatreaksi antara gas CO dengan udara. Dalam industri banyak dipergunakan nikel atauplatina sebagai katalis pada reaksi hidrogenasi terhadap asam lemak tak jenuh. Katalis platina, digunakan pada proses Oswald dalam industri asam nitrat, pengubah katalitik pada knalpot kendaraan bermotor